대상 제품은 케이캡정 25mg과 50mg 등 두 개다. 위원회는 케이캡정 50mg에 대해 △미란성 위식도역류질환 △비미란성 위식도역류질환 △위궤양 적응증 허가를 권고했다. 25mg 제품에 대해서는 △미란성 위식도역류질환 치료 후 유지요법 적응증 허가 권고 의견을 냈다.
|
HK이노엔은 지난 2022년 인도 현지 제약사 닥터레디(Dr. Reddy’s Laboratories)와 인도, 남아프리카공화국 및 동유럽 등 총 7개국 수출계약을 맺었다.
인도는 인구 수가 14억 5000만 명으로 전세계에서 가장 많고 소화성 궤양용제 시장규모로는 중국, 미국, 일본에 이어 4번째로 크다.
|
HK이노엔 관계자는 “케이캡은 이번 인도 허가 권고 이후 내년 현지 허가 승인을 받을 것으로 기대된다”며 “앞으로도 글로벌 주요 국가에 속속 허가 및 출시되면서 케이캡의 영향력이 한층 더 높아질 것”이라고 전했다.
대한민국 제30호 신약인 케이캡은 2019년 P-CAB계열 위식도역류질환 치료제로 국내에 출시됐다. 복용 후 1시간 내에 빠르게 약효가 나타나고, 6개월 장기 복용 시에도 유효성 및 안전성을 확보한 점이 특징이다.
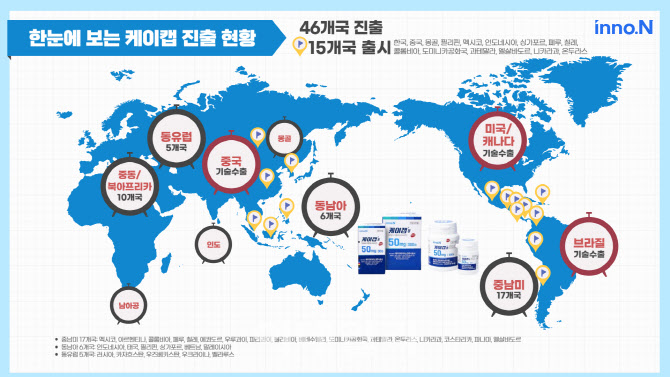
케이캡은 한국을 포함해 중국, 미국, 인도, 중남미 등 전세계 46개국에 진출했다. 진출 국가별 허가 및 출시 절차를 밟고 있는 가운데 현재까지 총 15개 국가에 출시됐다. 국내에서는 올해 1월부터 10월까지 1602억원의 원외처방실적을 기록했고, 4년 연속 국내 소화성 궤양용제 시장 1위를 차지하고 있다.



![피아니스트 아내의 문란한 성생활...그 끝은 '납치살해' [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120200065t.jpg)

