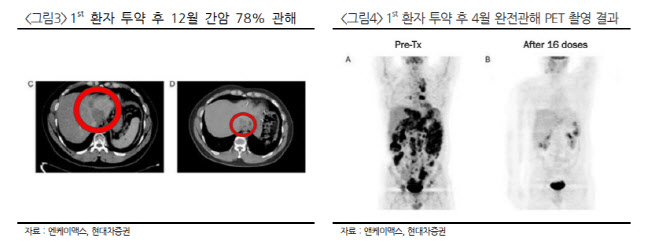
엔케이맥스는 자가 NK세포를 대량 배양해 다시 환자에게 투여하는 NK세포치료제 개발 기업으로 기존 면역관문억제제의 반응률이 낮은 환자들을 대상으로 병용투여 임상1상을 진행 중이다. 전날 동정적사용승인(EAP, 품목허가 전 약물 투여) 중 한 명이 지난해 12월 간에서 78%의 관해를 보였는데 그 환자가 종양이 완전히 제거된 상태를 뜻하는 완전관해가 됐음을 발표했다. 현재 임상 1상과 별개로 미국 식품의약국(FDA)으로부터 EAP를 받아 두 명의 불응성 고형암 환자가 머크의 키트루다와 SNK01 병용투여 요법을 진행 중이다.
|
불응성 고형암 환자를 대상으로 SNK01, 바벤시오 병용 투여 임상 1상에서 13명의 환자 중 한 명이 완전관해를 이뤘고 이번 임상종양확회(ASCO)에서 이번 임상의 추가 결과가 발표 예정돼 있다. 임상 1상은 코호트(Cohot)4에서 총 18명의 환자가 병용 투여되며 그 중 15명이 SNK01, 바벤시오 투약을 받고 3명이 SNK01, 키트루다 투약을 예정하고 있다.
엄 연구원은 “이번 ASCO에서는 SNK01, 바벤시오 병용 투여의 두 명에 대한 추가 결과가 발표될 것”이라면서 “주목할 만한 부분은 이번 ASCO학회에서 SNK01, 키트루다 투약 예정이던 3명에 대한 결과도 발표될 가능성이 높으며 동정적 사용허가로 완전관해가 나온 상황이기 때문에 ASCO학회에서 키트루다 병용이 발표된다면 높은 유효성이 발표될 가능성 높다”고 전망했다.
이번 결과는 불응성 고형암 중에서도 근육과 뼈에서 암이 자라는 말기 육종암 환자에게서 완치가 됐다는 면에서도 의미가 크며, 특히 면역관문억제제의 대표 기전인 PD-1(키트루다, 동정적 사용)과 PD-L1(바벤시오, 임상 1상) 병용요법 모두에서 완전관해가 나온 것이다.
SNK01이 투여된 후 PD-L1 음성 종양은 NK/T세포까지 활성화되며 사멸, NK/T세포가 종양을 공격하자 종양은 T세포 면역회피 기전으로 PD-L1을 발현하기 시작, 그 때 병용 투여된 키트루다 또는 바벤시오가 면역관문을 억제하고 T세포가 활성화되는 바탕이 마련되는 것이다.
엄 연구원은 “결국 PD-L1 발현량이 높아지며 PD-L1양성환자로 변화돼 키트루다와 바벤시오에 대해 반응이 없던 환자들이 반응률 향상돼 완전관해된 것으로 추정된다”면서 “메인 면역관문억제제 모두 병용 투여시 반응률 상승을 보여준 것으로 ASCO 학회 결과가 더욱 주목된다”고 강조했다.





![고맙다, 코스피!…연기금 줄줄이 '역대 최고 수익률' [마켓인]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26021001687t.630x.0.jpg)


