바이오마커란 질병에 대한 약물의 반응성을 객관적으로 측정하는 지표다. 루닛은 이를 AI로 수치화해 키트루다의 효율성을 최대한 끌어올릴 수 있는 기술을 확보했다.
최근 성과는 글로벌 1위 암 병원과 미국 빅파마 머크의 면역항암제 키트루다를 연구하는 과정에서 나왔다. 해당 병원과 다른 적응증에 대한 계약 등 추가 계약도 합의 단계인 것으로 알려졌다. 키트루다는 담도암 외 다른 희귀암으로 승인된 사례는 많지 않아 머크와의 계약 가능성도 열려있다.
MD앤더슨과 희귀암 효능 수치로 증명
7일 AI의료업계에 따르면 루닛은 미국 MD앤더슨과 1년의 연구 끝에 키트루다의 희귀암 환자 치료 효과를 증명했다. 미국 텍사스대 MD앤더슨 암센터는 뉴스위크가 지난 9월 월드 베스트 전문병원 암 분야 1위에 선정한 병원이다.
MD앤더슨은 ‘루닛 스코프 IO’를 활용해 10개의 희귀 암종 환자 84명을 분석했다. 종양 내 면역세포의 밀집도를 나타내는 ‘종양침윤림프구밀도(iTIL)’와 전체 조직 중 암세포가 차지하는 비율인 ‘종양 분율(TC)’을 측정했다. 키트루다 사용 시 두 지표 모두 반응을 보인 환자는 질병 진행 위험이 68%, 사망 위험이 72% 각각 감소했다. 이는 통계적으로도 매우 신뢰할 만한 수준(각각 P=0.003, P=0.009)이었다. 해당 내용은 학술 가치를 인정받아 SITC 100대 연구초록에 선정됐다.
|
서범석 루닛 대표는 “MD앤더슨과의 협력으로 임상 환경에서 검증된 이번 연구 결과는 치료 옵션이 제한적인 희귀암 환자들에게 새로운 희망이 될 것“이라며 ”앞으로도 루닛 스코프 IO의 활용 범위를 지속 확대하겠다“고 말했다.
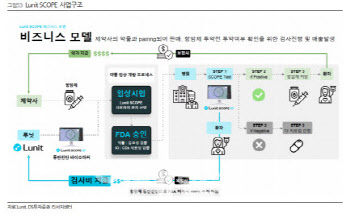
루닛 스코프가 키트루다 적응증 키운다...동반진단 시너지는?
해당 성과가 의미가 있는 건 면역항암제인 키트루다의 활용성을 더 높일 수 있기 때문이다. 키트루다는 작년 매출 250억 달러(약 25조원), FDA에 승인된 적응증은 40개에 달하는 글로벌 1위 의약품이지만 희귀암으로는 FDA 승인이 많지 않다. 이에 머크도 루닛의 연구에 주목하고 있는 상황이다.
머크가 결단한다면 FDA에 루닛 스코프와 키트루다를 다양한 희귀암 환자에게 동반진단으로 함께 사용하는 것으로 승인 신청을 할 수 있다. 약물-동반진단 검사는 항암제와 바이오마커가 ‘한 세트’로 사용되는 방식이다. 현재 FDA가 면역항암제 환자에게 권고하는 방식이기도 하다.
실제 FDA는 키트루다와 함께 사용되는 여러 동반진단 기기를 승인했다. 대표적으로 애질런트의 ‘PD-L1 IHC 22C3 pharmDx’가 있다. 이 기기는 비소세포폐암(NSCLC), 위암, 두경부암 등 다양한 암종에서 키트루다 치료에 적합한 환자를 선별하는 데 사용된다.
|
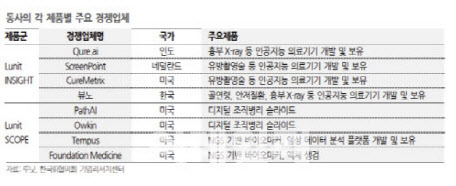
김민정 DS투자증권 연구원은 “면역항암제에서 바이오마커는 여러 제품이 상호보완 역할을 하면서 동시에 사용된다”며 “대표적인 면역항암제인 키트루다의 동반진단 바이오마커로 사용되는 PD-L1은 새로운 바이오마커가 출시된 이후에도 계속 사용되고 있다”고 설명했다.
그는 이어 “TMB, MSI 등 다른 바이오마커가 키트루다의 동반진단 바이오마커로 새롭게 승인되었으나 이들이 기존 바이오마커인 PD-L1을 대체하는 것이 아니라 추가검사로 함께 사용되고 있다”며 “이는 면역항암제 동반진단용 바이오마커 개발 시 큰 폭의 매출 성장이 가능하다는 것을 시사한다”고 덧붙였다.
한편 글로벌 시장조사기관 노바원어드바이저에 따르면, 전 세계 바이오마커 시장은 2023년 319억 달러(약 42조원)에서 2033년 1073억 달러(약 143조원)로 3배 이상 성장할 전망이다. 시장 성장과 함께 루닛 스코프의 매출도 2022년 약 40억원에서 2023년 67억원으로 크게 늘었다.