|
13일 제약바이오업계에 따르면 미국 규제당국이 디지털 치료기기에 대한 허가 입장을 내놓으면서 관련 업계가 수혜를 입을 수 있다는 전망이 나온다.
지난달 27일 미국 식품의약국(FDA)이 불면증 치료를 적응증으로 ‘모디우스 슬립’에 대해 510k 인증을 부여하는 결정을 내렸다. 2019년 뉴로시그마가 개발한 ADHD용 뇌 전기 자극 치료기기 ‘모나크 eTNS’ 이후 뇌질환 분야 두 번째 디지털 치료기기가 미국에서 승인된 것이다.
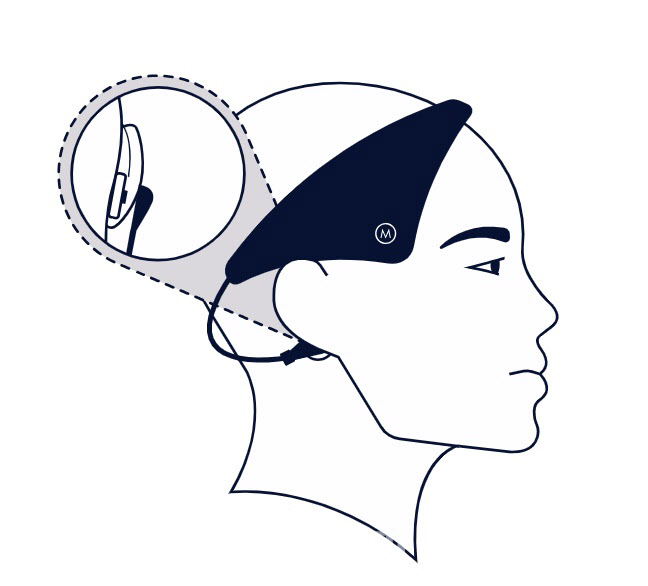
뉴로발렌스는 불면증 증세는 물론 비만과 제2형 당뇨와 같은 대사 질환 관련 치료 효능을 갖춘 비침습적 뇌 신경 자극용 디지털 치료기기 개발사로 알려졌다. 이들이 개발한 모디우스 슬립은 전기자극용 패드를 귀 뒤쪽 피부에 붙이는 헤드셋을 착용하는 형태로 구성된 기기다. 모디우스 슬립은 이미 영국과 유럽 연합 등에서 시판돼 있다.
뉴로발렌스에 따르면 패드를 통한 전기자극은 전정핵을 거쳐 미주핵을 자극하면 식용과 각성에 자극하는 신경전달물질인 오렉신의 신호전달체계에 작용하게 된다. 불면증 환자는 이 신호 전달체계가 제대로 작동하지 않는 것으로 알려졌다.
실제로 회사 측은 영국와 아일랜드 등 유럽에서 진행된 임상 참가자 20명을 대상으로 모디우스 슬립을 잠들기 1시간 전부터 약 30분씩 2주간 사용하게 한 다음 수면에 대해 느낀 점을 조사했으며, 이들의 수면 패턴을 촬영한 결과와 종합했다. 참가자들의 평균 ‘불면증 심각도 지수’(ISI)는 15.7로 일반적인 불면증을 겪는 수준이었다 모디우스 슬립을 2주간 사용한 이후 이들에서 해당 지수가 8.15(잠재적 불면증 위험군) 수준으로 떨어진 것이 확인됐다. 이 결과는 지난 2020년 ‘기초임상 생리학 및 약학 저널’ 온라인판에 실리기도 했다.
제이슨 맥코윈 뉴로발렌스 CEO는 지난 6일 뉴로로지라이브와의 인터뷰에서 “모디불면증을 관리하는 수준이 아닌 치료효능을 갖춘 기기다”며 “먹는 불면증 치료제와 달리 부작용도 없다. 미국을 포함해 출시국을 확대해 나가겠다”고 밝혔다.
디지털 치료기기 개발업계 한 관계자는 “뇌질환 관련한 신약이라면 효능을 떠나 부작용 데이터에 대해 FDA의 철저한 검증이 이뤄진다.”며 “전기자극형 치료기기가 부작용 이슈에서 비교적 자유로워, 미국 내 승인 절차가 순조롭게 이뤄지는 측면이 있다”고 말했다.
이밖에도 지난 4월 미국 리치뉴로가 개발 중인 뇌졸중 환자 치료용 척수 자극 치료기기가 미국에서 혁신 의료기기로 인정받았다. 뉴로시그마나 리치뉴로, 뉴로발렌스 등 전기자극용 치료기기를 개발한 기업들은 모두 자사 기기의 일부 치료 효능을 입증한 데이터를 제시한 것으로 알려졌다.
◇비스토스, “ADHD 뇌질환 치료기 내년 초 FDA 승인 목표”
전기신호 기반 태아심음 측정기기 개발 전문기업으로 출발한 비스토스도 현재 ADHD 대상 뇌질환 자극용 치료기기 ‘BT1000’을 개발하는 중이다.
회사 측에 따르면 BT1000은 경두개를 지나가는 삼차신경에 비침습적 전기자극을 가한 다음 증상 개선할 수 있을 것으로 분석되는 치료기기다. 비스토스는 BT1000과 관련한 전기자극장치 관련 특허에 대해 지난해 각 한국과 미국에서 특허를 등록하는 데 성공했다.
이날 팜이데일리의 취재를 종합하면 비스토스는 내년 초에 자체 개발한 BT1000이 미국에서 510k 인증을 획득할 수 있을 것으로 예상하고 있다. 회사 관계자는 “우리의 치료기기가 미국 내 최초 사례라면 승인 절차는 매우 까다로울 수밖에 없다”며 “BT1000과 적응증까지 같은 뉴로시그마의 제품이 이미 있다”고 운을 똈다.
실제로 의료기기 관련 FDA의 510k 인증은 이미 상용화된 제품 비교 데이터를 바탕으로 승인 절차를 밟을 수 있는 것으로 알려졌다. 비스토스 관계자는 이어 “뉴로시그마의 제품과 BT1000을 비교하는 데이터를 만들었고 추가 검증 절차를 진행하는 중”이라며 “초기 생성된 데이터를 바탕으로 BT1000의 허가 신청을 완료했다. 내년 3~4월 경에는 510k 인증 획득이 가능할 것으로 보고 있다”고 전망했다.
한편 비스토스는 태아심음측정기와 태아 감시 장치, 보육기 등을 120여 개국에 출시한 산모 의료기기 전문기업으로 지난해 10월 스펙5호 상장에 성공했다. 이들 제품을 통해 올 상반기 동안 매출 135억8700만원의 매출을 올린 것으로 확인됐다.



![친누나 11차례 찔러 죽이려한 10대에...법원 “기회 주겠다” [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700001t.jpg)
