◇7개 제품 허가 완료…내년 암젠 제품 시작으로 출시 이어져
휴미라 바이오시밀러를 개발 중인 기업은 암젠, 화이자 등 세계적으로 10곳 이상이다. 암젠, 비아트리스, 베링거인겔하임, 삼성바이오에피스, 코허루스 바이오사이언스, 화이자, 산도즈 등 7개 기업이 이미 바이오시밀러를 미국 식품의약국(FDA)에서 허가받았다. 셀트리온과 프레지니우스카비, 알보텍 제품은 심사 중이다.
오리지널 의약품인 휴미라는 지난해 207억달러(약 25조3400억원)의 매출을 기록했다. 이중 미국 시장 규모는 173억3000만달러(약 21조 2120억원)로 84%가량을 차지한다. 릭 곤잘레스 애브비 CEO는 지난 2월 실적발표에서 “(바이오시밀러 등장에 따라) 휴미라 매출이 2023년부터 최소 35%에서 최대 55% 타격을 받을 수 있다”고 내다봤다. 휴미라는 류머티즘성 관절염과 건선, 크론병 등에 쓰이는 치료제다. 미국에서 2016년 12월 물질특허가 만료됐으나, 애브비는 2023년부터 바이오시밀러 출시가 가능하도록 개발사들과 합의해왔다.
|
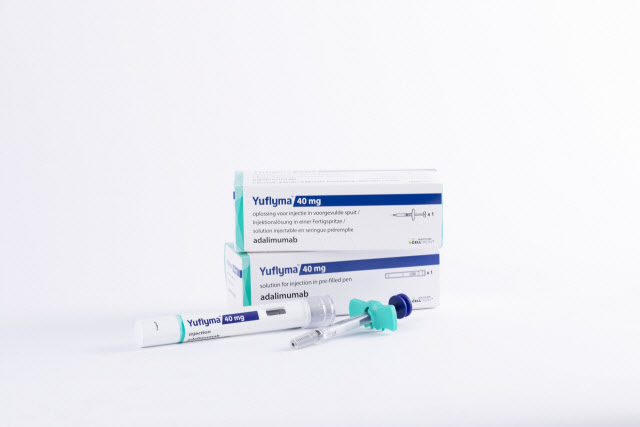
휴미라 바이오시밀러 시장에는 암젠의 ‘암제비타’가 내년 1월 31일 먼저 모습을 드러낼 전망이다. 이어 6월에는 삼성바이오에피스 ‘하드리마’, 7월에는 베링거인겔하임 ‘실테조’, 알보텍 ‘AVT02’, 9월에는 산도즈의 ‘하이리모즈’, 11월에는 화이자의 ‘아브릴라다’가 각각 출시될 예정이다. 셀트리온은 2020년 11월 FDA에 ‘유플라이마’ 허가를 신청해 연내 승인을 기대한다. 애브비와 특허 합의에 완료해 내년 7월부터 미국 판매가 가능하다는 게 회사 설명이다.
휴미라 바이오시밀러 시장에 진출할 채비를 하는 글로벌 제약사들은 주로 ‘오리지널약과의 대체조제’로 승부수를 띄우고 있다. 베링거인겔하임은 휴미라의 첫 번째 인터체인저블 바이오시밀러 자격을 얻었다. 인터체인저블 바이오시밀러는 오리지널약과 같은 임상적 결과를 냈다는 것을 FDA가 인정하는 것으로, 의사 처방 없이 약사가 바이오시밀러를 대체 조제할 수 있다. 바이오시밀러 퍼스트 무버 자격을 갖춘 암젠과, 화이자도 인터체인저블 바이오시밀러를 위한 추가 임상을 진행 중이다.
◇3년간 축적 데이터 vs 세계 최초 고농도 타이틀 vs 가격 경쟁력
국내 기업 중에서는 삼성바이오에피스가 시장에 먼저 출격할 전망이다. 삼성바이오에피스는 차별점으로 3년 이상 유럽 판매를 통해 축적된 데이터를 꼽았다. 2018년 10월 유럽에서 휴미라 바이오시밀러 ‘임랄디’를 출시해 판매해왔다. 회사 관계자는 “의사들이 처방할 때 가장 중요하게 보는 게 ‘처방 데이터’다. 유럽에 휴미라 바이오시밀러가 6개 정도 출시된 상태지만 2018년 10월에 처음 출시된 것은 우리 제품을 비롯해 몇 개 되지 않는다. 축적된 경험과 데이터를 바탕으로 영업 마케팅에 나서면서 경쟁력을 갖추려고 한다”고 했다.
회사 측은 고농도 제품 자체만으로는 크게 차별점이 되지 않으리라 내다봤다. 삼성바이오에피스는 고농도 제형 개발을 완료했다. 저농도 제품은 이미 FDA 허가를 받았고, 고농도 제품은 임상을 마친 뒤 변경 허가를 신청해둔 상태다. 인터체인저블 바이오시밀러는 아직 검토 중인 상황이다.
회사 관계자는 “인터체인저블 바이오시밀러 허가를 받으면 (점유율 확보에) 도움이 된다고 딱 잘라 말할 수는 없다. 임상을 따로 진행해야 하는데, 비용과 시간을 감수하며 받을 건지는 각 기업의 전략에 맞춰 진행한다”고 설명했다. 대형병원만 공략할 시 인터체인저블 바이오시밀러 허가를 굳이 받지 않을 수도 있다는 게 업계 이야기다.
셀트리온은 최초로 약물 투여량을 절반으로 줄인 고농도 제품을 개발했다는 데서 상품성이 있다고 내다봤다. 셀트리온 관계자는 “대부분의 회사가 저농도로 개발하거나, 저농도 개발 후 고농도로 개발을 진행한다. 우리는 처음부터 고농도 제품으로 개발해 세계 최초로 글로벌 규제기관 허가를 받았다는 데서, ‘세계 최초’라는 타이틀로 차별화된 상품성을 강조할 수 있다”고 말했다. 셀트리온은 지난해 유럽에서 휴미라 바이오시밀러를 판매 허가받았다.
|
프레스티지바이오파마는 ‘PBP1502’에 대한 임상 1상 단계를 밟고 있다. 바이오시밀러의 경우 임상 2상을 건너뛸 수 있다. 프레스티지바이오파마 관계자는 “이르면 올해 하반기부터 임상 3상을 진행할 예정이며, 내년에 FDA와 EMA에 품목허가 신청을 제출할 계획이다. 2024년에는 미국 시장에 진출할 수 있을 것으로 보고 있다”고 말했다.
프레스티지바이오파마는 가격 경쟁력으로 승부를 볼 전망이다. 회사 관계자는 “Non-Protein A 특허기술을 통해 고가의 단백질 A 컬럼을 사용하지 않고도 항체를 정제할 수 있다. 원가절감 요소를 통해 경쟁사 대비 40%의 가격 경쟁력을 가지고 시장에 진출할 것”이라고 설명했다.




![아파트에서 숨진 트로트 여가수…범인은 전 남자친구였다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000001t.jpg)
