3일 앱클론에 따르면, 지난주 식품의약품안전처는 앱클론이 신청한 AT101의 임상 2상의 임상시험계획 변경 신청에 대해 승인했다. 앱클론은 곧 본격적인 임상 2상에 돌입할 예정이다.
앱클론은 임상 2상의 빠른 진행을 위해 기존 임상 1상을 진행했던 서울아산병원, 아주대병원, 울산대병원, 동아대병원 뿐 아니라 서울삼성병원, 서울대병원, 여의도성모병원 등 추가 3개 병원에서도 임상을 진행한다.
임상 1상 다수 차지한 ‘DLBCL’, 임상 2상 상세 암종으로 확정
앱클론은 이번 임상시험계획 변경을 통해 AT101의 임상 2상 상세 암종을 ‘재발성 또는 불응성 미만성 거대 B세포 림프종’(DLBCL)으로 결정했다. 이에 따라 임상 2상에서는 재발성 또는 불응성 DLBCL 환자 총 82명을 모집한다는 계획이다.
AT101은 임상 1상 중 중용량과 고용량 투여군에서 100%의 완전관해율을 달성한 바 있다. 전체 시험 대상자 기준 완전관해율은 75%를 기록하는 등 매우 의미 있는 결과를 도출했는데, 당시 환자군을 세부적으로 살펴보면 전체 대상자 12명 중 7명이 재발성 또는 불응성 DLBCL 환자였다.
즉 앱클론은 긍정적 결과를 도출한 임상 1상 대상자 중 가장 비중이 높았던 질환을 임상 2상 주요 대상자로 선택함으로서 임상 성공확률을 높이는 전략을 세운 것이다.
앱클론 관계자는 “임상 모집 인원은 유의미한 수준의 데이터를 확보하는데 충분한 수치”라며 “임상 1상에서 좋은 결과를 보였던 재발성 또는 불응성 DLBCL 환자 중심으로 모집할 예정”이라고 말했다.
시장 규모 측면에서도 최선의 선택이라는 분석이 나온다. 전체 혈액암 환자 중 약 40% 가량이 DLBCL 환자이기 때문이다. 실제로 DLBCL 등의 적응증을 보유한 노바티스 ‘킴리아’와 길리어드사이언스 ‘예스카타’는 지난해 각각 약 7100억원, 1조5000억원의 매출을 올렸다.
폴라리스 마켓 리서치 분석에 따르면, CAR-T 치료제 적용이 가능한 B세포림프종 글로벌 시장 규모는 2029년 약 23조원에 달할 것으로 전망된다.
|
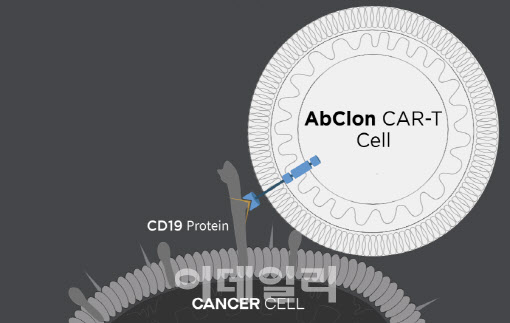
AT101은 현재 상용화된 CAR-T 치료제 킴리아, 예스카타와 같은 CD19를 표적으로 하지만 항원 결합 부위(에피토프, epitope)에서 차이가 있다. 현재 CD19를 타깃하는 약물들은 세포막과 먼 부위에 붙지만, AT101은 상대적으로 세포막과 더 가까운 곳에 결합해 효과를 높일 것으로 예상된다.
앱클론 관계자는 “현재 CD19를 타깃하는 약물들은 세포막과 먼 부위에 붙지만, AT101은 상대적으로 세포막과 더 가까운 곳에 결합해 더 뛰어난 효과를 보일 것으로 기대된다”고 설명했다.
또 항체에서의 차이도 있다. 기존의 CAR-T 치료제들은 생쥐 유래 ‘FMC63’항체를 이용하지만 앱클론은 자체 개발한 인간화항체 ‘h1218’를 사용한다. 인간화항체인 만큼 면역반응 유발이 최소화되면서 약효 지속성도 늘어나는 구조다.
DLBCL 외 다른 혈액암 적응증 확대 가능성도
DLBCL 외 다른 혈액암 적응증 확대 가능성도 있다. 현재 허가된 글로벌 제약사들의 CAR-T 치료제 역시 우선 허가 후 적응증 확대 전략을 취하고 있기 때문이다.
노바티스 킴리아는 재발난치성 급성림프구성백혈병(ALL)로 우선 허가 받은 뒤 재발 및 불응성 거대 B세포 림프종에 이어 소포성림프종(FL) 적응증을 연이어 추가하면서 총 3가지 질환 적응증을 확보했다.
다만, 아직까지 앱클론은 추가 적응증 확보보다는 타깃으로 결정한 재발성 또는 불응성 DLBCL에 대한 치료 효과에 집중한다는 계획이다.
앱클론 관계자는 “다른 적응증 확보에 대한 계획은 아직 없다”라며 “임상 2상 대상자인 재발성 또는 불응성 DLBCL 환자에 대한 효과 확인에 집중할 것”이라고 말했다.