|
김태규 바이젠셀 대표는 21일 이데일리와 인터뷰를 갖고 “최근 서울 가산동에 자체 첨단바이오의약품 GMP 생산시설을 완공, 상업용 ‘올인원(All-in-one)’ 패키지 사업이 가능한 기반을 구축했다”면서 “이제부터는 신약 개발속도가 본궤도에 오르게 됐다”고 설명했다. 맞춤(자가) 치료제는 환자 본인의 몸안에 있는 인체 성분을, 범용(동종) 치료제는 타인의 인체성분을 각각 활용한다는 점에서 근본적 차이가 있다.
김대표는 “맞춤과 범용 면역세포 치료제 모두를 동시에 개발하는 곳은 세계적으로도 찾아보기 드물다”면서 “의대교수로 재직하면서 지난 20여년간 축적한 면역세포 치료제 기술이 있었기에 바이젠셀은 창업때부터 동시에 두 분야를 파이프라인으로 연구, 개발할수 있었다”고 소개했다. 실제 면역세포 치료제 분야에서는 대부분 바이오기업은 두 분야를 한꺼번에 뛰어들지 못하고 범용 면역세포 치료제만을 개발하고 있다. 여기에 맞춤 면역세포 치료제 개발은 기술적으로 더욱 난이해서 극소수 기업만이 나선 상황이다.
김대표는 가톨릭대 의대 교수를 겸임하면서 지난 2013년 가톨릭대 기술지주회사의 제1호 자회사로 바이젠셀을 창업했다. 세계적 T세포 치료제 전문가로 손꼽히는 김대표는 그간 이 분야 연구로 134건의 과학기술논문인용색인(SCI)급 논문을 게재했다.
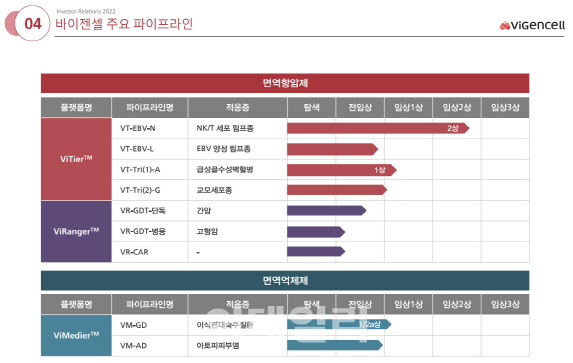
바이젠셀은 면역항암제인 바이티어(ViTier™), 바이레인저(ViRanger™)와 면역억제제 바이메디어(ViMedier™)등 모두 3가지 플랫폼 기술을 바탕으로 9개 파이프라인을 연구개발 중인 바이오기업이다. 이들 3가지 플랫폼은 세포 하나로 다양한 질병에 대한 치료제를 각각 개발할수 있어 확장성이 무궁무진하다는 공통점을 갖는다.
특히 바이젠셀은 면역세포 치료제 분야에서 세계적인 기술력을 보유하고 있는 기업으로 평가받는다. 실제 바이젠셀은 바이메디어 플랫폼을 활용, 제대혈 유래 골수성 억제세포(MDSC)를 기반으로 하는 치료제 개발을 위해 세계 최초로 임상 시험을 진행하면서 업계의 주목을 받고 있다. 김대표는 “면역세포 치료제 분야에서 글로벌 선두그룹과 그리 차이가 나지 않는다”면서 “현재 개발중인 치료제 파이프라인들이 예정대로 좋은 결과가 나오게 되면 세계 최고의 면역세포치료제 전문기업으로 거듭날 수 있을 것이라 확신한다”고 말했다.
바이젠셀이 개발하고 있는 치료제 가운데 가장 앞선 것은 NK/T세포 림프종 치료제(VT-EBV-N)가 손꼽힌다. 현재 임상2상을 진행중이다. 이 치료제는 T세포 림프종 환자 11명을 대상으로 한 임상1상에서 5년간 장기관찰한 결과 ‘무재발 생존율이 90%’에 이르는 것으로 나타나면서 업계의 비상한 관심을 받았다.
그는 “림프종은 기존 치료제를 쓰면 일시적으로 종양이 사라지거나 줄어들지만 50~70% 가량이 재발하는 것이 가장 큰 걸림돌이다”면서 “특히 종양이 재발되면 어떤 치료제도 잘 듣지 않기 때문에 환자에게는 그야말로 치명적인 결과를 가져오게 된다”고 설명했다.
바이젠셀이 현재 진행하고 있는 NK/T세포 림프종 치료제(VT-EBV-N) 임상2상은 T세포 림프종 환자 48명을 대상으로 하고 있다. 임상2상 결과가 성공적으로 나오게 되면 빠르면 2024년 식약처로부터 조건부 품목허가를 받을수 있을 것으로 예상된다. 이 치료제는 지난 2019년 개발단계 희귀의약품으로 지정을 받은 바 있다. 조건부 품목허가는 임상 2상 자료를 바탕으로 의약품 시판을 허가하는 제도다.
T세포 림프종 환자는 국내에서만 매년 400여명이 발생하는 것으로 추산된다. 국내 T세포 림프종 치료제 시장규모는 500억원 가량이다. 세계적으로 T세포 림프종 환자가 가장 많이 발생하는 나라는 중국이다. 매년 1만1000여명의 T세포 림프종 환자가 발생한다. 이 질환과 관련한 중국 치료제 시장규모는 1조6000억원을 넘어선다. 미국등 서양에서는 T세포 림프종 환자가 극소수라는 게 김대표의 설명이다. 서양인의 식습관이나 인종적 습관이 동양인과 달라 이런 결과가 나온다는 게 관련 업계의 추정이다.
|
“내년에는 바이메디어 플랫폼의 아토피치료제 파이프라인(VM-AD)에 대한 호주 임상1상을 원활하게 진행해 기술수출 계약을 체결하는 것이 목표다. 이를 위해 올해 3월 호주 법인을 설립했다. 4분기에는 호주임상을 위한 임상시험계획서(CTN)을 신청할 예정이다.”
그는 “아토피치료제 파이프라인(VM-AD)은 전임상에서 아토피피부염 동물모델 실험을 통해 유의한 효능을 확인한 바 있다”면서 “지난 5월에는 미국면역학회(AAI)에서 구두발표도 하면서 상당한 호응을 얻었다”면서 치료제 개발에 자신감을 내보였다.
최근 바이젠셀(308080)은 개발중인 급성골수성백혈병 치료제(VT-Tri)에 대해 식약처로부터 개인별 환자대상 치료 목적으로 사용하는 것을 승인받으면서 주목을 받기도 했다. 김대표는 “65세 이상 급성골수성백혈병 고령환자는 5년 내 생존율이 20%에 못 미칠 정도로 치명적인 질환이다”면서 “기존 치료제가 듣지 않거나, 잦은 재발이 일어나는 환자의 경우 의료진의 판단하에 치료목적 사용을 신청하게 되는 것이라 ‘VT-Tri’에 대한 니즈를 다시 한 번 확인하는 계기가 됐다”고 의미를 부여했다.