|
8일 업계 따르면, 녹십자가 미국 식품의약국(FDA)와 ‘IVIG-SN 10%’ 품목허가를 위해 내년 1분기 현장실사 일정을 논의 중인 것으로 확인됐다.
IVIG-SN은 항체(면역글로불린)제제로 항원 자극으로 면역반응을 유도해 질병을 치료한다. 혈액은 적혈구·백혈구·혈소판 등의 고형 성분과 알부민·면역글로불린·응고성 단백질 등으로 이뤄진 액체 성분으로 구분된다. 혈장에 있는 면역글로불린은 특정 항원과 결합해 항원-항체 반응을 유도한다. 이를 통해 면역글로불린은 인체 침입한 세균이나 바이러스를 무력화시킨다. 이 제제는 면역글루볼린 함유 농도에 따라 5%와 10%로 구분된다.
당초 녹십자는 지난 2015년말 IVIG-SN 5%에 대해 FDA 품목허가 신청을 냈다. 하지만, 이듬해 11월 FDA로부터 제조공정 관련 자료 보완하라는 통보를 받았다. 이후 녹십자는 IVIG-SN 5%에 대해 품목허가 재신청을 했으나 2017년 9월 같은 이유로 FDA 품목허가가 불발됐다.
연속된 허가 불발에 녹십자는 계획을 바꿔 IVIG-SN 10%를 먼저 미국에 출시하기로 결정했다. 녹십자는 지난해 2월 FDA에 IVIG-SN 10%에 대해 품목허가 신청을 냈으나, 보완요구서(CRL)를 수령하면서 다시 한번 미국 출시에 실패했다. 녹십자의 이번 면역글로불린제제 FDA 품목허가 도전은 4번째다.
◇ “수차례 모의검사 실시”
녹십자는 IVIG-10% 대해 내년 FDA 품목허가를 자신했다. 녹십자 관계자는 “외부 전문가로 이뤄진 태스크포스(TF)를 구성해 수차례 모의검사를 실시했다”면서 “이를 통해 실사 준비에 대해 철저히 만전을 기했다”고 강조했다.
설령 내년 1분기 IVIG-10% 실사에서 결과가 미흡해도 보완시간이 충분하단 입장이다. 녹십자 관계자는 “통상 품목허가 신청 후 실사를 진행한다”면서 “하지만 내년 초 실사는 이례적으로 품목허가 신청 전에 이뤄진다. 설령 보완이 필요하다고 해도 품목허가 신청 전까지 충분한 대응 시간이 있다”고 강조했다.
IVIG-10%는 품목허가만 받으면 곧장 미국 시장침투가 가능할 것으로 내다봤다. 그는 “면역글로불린제제는 혈액 제제이기 때문에 다른 치료제처럼 공장에서 찍어낼 수 없다”면서 “항상 수요 대비 공급이 부족한 시장이기 때문에, 치료제 출시만 이뤄진다면 곧장 미국 시장에서 점유율 확보가 가능할 것으로 보고 있다”고 말했다.
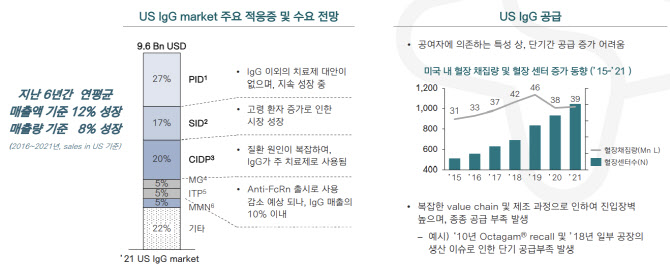
면역글로불린제제는 혈액 확보에 대한 어려움과 복잡한 제조 방식 때문에 시장 진입 장벽이 높다. 특히, 혈장에서 면역, 지혈 등 작용을 하는 단백질 성분만 골라내 고순도로 분리하는 기술 난이도가 높다. 면연글로불린제제는 공급 부족에 따라 최근 1년 간 글로벌 평균 공급가격이 21% 올랐다.
|
바이오 시장 조사 전문기업 ‘MRB’(The Marketing Research Bureau)가 발간한 보고서에 따르면, 지난해 미국 전체 면역글로불린제제 시장 규모는 96억달러(12조 6576억원)로 집계됐다. 미국시장에서 면역글로불린제제 전체 매출액은 지난 6년간 연평균 12%씩 성장했다. 면역글로불린제제는 △선천성 면역 결핍증 △후천성 면역 결핍증 △만성염증성신경병증 △중증근무력증 △면역성 혈소판감소증 △다병소성 운동신경병증 등을 적응증으로 한다.
◇ 혈액확보부터 판매계획까지 수립
녹십자는 면역글로불린제제 FDA 품목허가를 확신하고 이미 미국시장 침투 세부계획을 수립했다.
녹십자 관계자는 “미국에서 IVIG-10% 품목허가를 받게 되면, 앵글로색슨족(미국인) 피로 제제를 만들어야 한다”면서 “미국은 헌혈과 같은 공여자에 의존하는 국내와 달리, 돈을 주고 사는 매혈이 가능하다. 혈액 확보에 문제없다”고 밝혔다.
녹십자는 미국에서 사들인 혈액을 충복 오창공장으로 보내 IVIG-10%를 제조한 뒤 미국으로 다시 수출할 계획이다.
면역글로불린 판매채널도 구체화했다. 미국 의료보건 시스템은 전문약국·홈케어 50%, 병원 40%, 진료병원(Physician‘s Office) 10% 등으로 나뉜다. 전문약국·홈케어는 병원 방문이 어려운 환자들을 위한 의료시스템이다. 진료병원은 병상없이 의사가 진료만 하는 시설을 가리킨다.
그는 “IVIG-10%는 미국 내 전문약국 채널에 집중해 시장을 공략할 계획”이라면서 “전문약국은 여타 채널 대비 치료제 공급가격이 높게 형성돼 있다. 아울러 전국 단위의 영업조직 대신 소수 영업인력으로도 매출 극대화가 가능하다”고 설명했다. 이어 “반면 미국 6200여 개 병원은 도매상을 통해 치료제를 공급받고, 진료병원은 전국 단위 영업력을 필요로 한다”고 부연했다. 녹십자는 IVIG-10%의 FDA 품목허가가 나면 중소제약사 의약품 처방비중이 높은 전문약국과 계약체결을 시도할 계획이다.
녹십자 관계자는 “과거엔 생산 배치(batch) 간 동등성 입증을 실패했다는 이유로, 최근엔 코로나19로 인해 실사 자체가 불발되면서 면역글로불린제제가 FDA 품목허가를 받지 못했다”면서 “과거 지적받은 문제점은 보완했고, 실사일정 논의가 최종 단계에 있기 때문에 긍정적인 결과를 기대한다”고 말했다. 이어 “미국에선 환자 10명 중 7명이 10% 제제를 투약한다”며 “IVIG-10% 품목허가에 따른 외형성장 기대감이 크다”고 덧붙였다.
한편, 녹십자의 면역글로불린제제는 지난 2010년 식약처로부터 허가를 받았다. 현재 브라질, 파키스탄 등 15개국에서 허가를 받아 수출 중이다.




![친누나 11차례 찔러 죽이려한 10대에...법원 “기회 주겠다” [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700001t.jpg)
